今有HA、H2B两种弱酸,有如下关系:H2B+A-=HB-+HA B2-+HA=HB-+A-则下列说法正确的是:
A、H2B的电离方程式为:H2B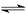 2H+ + B2-
2H+ + B2-
B、结合质子能力由强到弱的顺序为:B2->A->HB-
C、等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强
D、等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者
答案:B
题目分析:反应1可以看到,H2B-<HA(电离理论),所以酸性HA>H2C->HC2- 反应2中HB-<HA(同上)。因为B2-的碱性最强,质子水解一般显酸性且B2-的带电量最大,最容易吸引质子,HB-的酸性最强,质子水解一般显酸性且HB-的带电量最小,吸引质子的能力较小。故选B。
点评:本题考查的是弱电解质的电离,从方程式中比较,容易得质子的离子,碱性强,反之,酸性强。
