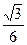问题
选择题
在KIO3、KHSO3的酸性混合溶液中,加入少量KI和淀粉,不停地搅拌,有下列反应发生:①I
+5I-+6H+=3I2+3H2O②3I2+3HSO -3
+3H2O=6I-+3HSO -3
+6H+,总反应为:IO -4
+3HSO3=I-+3HSO -3
;当反应进行到15min时,溶液突然变为蓝色,随之又很快消失,这一反应称为时钟反应,有人用它来解释生物钟现象.下列有关说法错误的是( )O -4
A.在整个时钟反应过程中,起催化作用的物质是KI
B.上述两个反应中,反应速率较快的是②
C.时钟反应的快慢由反应②决定
D.“溶液突然变为蓝色,随之又很快消失”,这一现象与①②的反应速率有关
答案
A.抓住催化剂的主要特征,在反应前后都有,①IO3-+5I-+6H+→3I2+3H2O ②3I2+3HSO3-+3H2O→6I-+3SO42-+9H+,将①×6+②×5得:6IO3-+15HSO3-═15SO42-+3I2+9H++3H2O,KI起催化作用,故A正确;
B.当反应进行到15min时,溶液突然变为蓝色发生反应,发生反应①,随之又很快消失,很快消失说明②的反应速率大于①;
C.反应②为快反应,反应①为慢反应,由反应①决定时钟反应,故C错误;
D.当反应进行到15min时,溶液突然变为蓝色发生反应,发生反应①,随之又很快消失,很快消失说明②的反应速率大于①,现象与①②的反应速率有关,故D正确;
故选C.