金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用.
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示.镁与盐酸反应的离子方程式为______;在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:______.
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式______.
(3)Mg-Al可形成原电池:
| 编号 | 电极材料 | 电解质溶液 | 电子流动 方向 |
| 1 | Mg-Al | 稀盐酸 | Mg流向Al |
| 2 | Mg-Al | NaOH溶液 |
①实验1中Mg为______极;
②实验2中电子流动方向______,Al为______极,为什么?______.
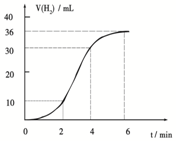
(1)镁与盐酸反应生成氯化镁和氢气,反应的离子方程式为Mg+2H+═Mg2++H2↑,在前4min内,镁条与盐酸的反应速率逐渐加快,原因是镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大,在4min之后,反应速率逐渐减慢,原因是4min后由于溶液中H+浓度降低,所以导致反应速率减小,
故答案为:Mg+2H+═Mg2++H2↑;镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大,4min后由于溶液中H+浓度降低,所以导致反应速率减小;
(2)氢氧化镁和氯化铵反应生成氯化镁和一水合氨,反应的离子方程式为Mg(OH)2(s)+2NH4+═Mg2++2NH3•H2O,
故答案为:Mg(OH)2(s)+2NH4+═Mg2++2NH3•H2O;
(3)①Mg比Al活泼,在酸性条件下镁为负极,
故答案为:负;
②因铝可与强碱反应,则在碱性条件下铝为负极,电子由铝流向镁,
故答案为:Al流向Mg;负;Al能和NaOH溶液反应而Mg不能,故Al作负极,Mg作正极.
