某化学反应2A(g) B(g)+D(g)在密闭容器中分别在下列四种不同的条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在密闭容器中分别在下列四种不同的条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验序号 时间 | 0 | 2 | 3 | 4 |
| 800 | ℃ | 800 | ℃ | |
| 1 | 1.0 | c2 | c3 | 1.0 |
| 10 | 0.80 | 0.60 | 0.92 | 0.20 |
| 20 | 0.67 | 0.50 | 0.75 | 0.20 |
| 30 | 0.57 | 0.50 | 0.63 | 0.20 |
| 40 | 0.50 | 0.50 | 0.60 | 0.20 |
| 50 | 0.50 | 0.50 | 0.60 | 0.20 |
| 60 | 0.50 | 0.50 | 0.60 | 0.20 |
(2)实验2中,A的初始浓度c2=______________mol·L-1,反应经20 min就达到平衡,可推测实验2中隐含的条件可能是_______________。
(3)若实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3______________v1(填“<”“>”或“=”=,且c3______________(填“<”“>”或“=”=1.0 mol·L-1。
(4)比较实验4和实验1,可推测该反应的正反应是______________(填“吸热”或“放热”反应)。理由是__________________________________________________________________。
(1)0.013 mol·L-1·min-1
(2)1.0 使用催化剂
(3)> >
(4)吸热 温度升高,平衡向正反应方向移动,所以正反应为吸热反应
(1)v(A)=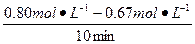 ="0.013" mol·L-1·min-1
="0.013" mol·L-1·min-1
(2)对比实验2与实验1,可知从10 min到20 min,实验1中A的浓度相同,说明是同一平衡状态,即c2="1.0" mol·L-1。又因实际反应的速率快,达平衡所需的时间短,说明反应中使用了催化剂。
(3)对比实验3与实验1,可知从10 min到20 min,实验1中A的浓度变化值为0.13 mol·L-1,而实验3中A的浓度变化值为0.17 mol·L-1,这就说明了v3>v1。又知实验3中从0 min到10 min A的浓度的变化值应大于0.17 mol·L-1,即c3>(0.92+0.17)mol·L-1。
(4)对比实验4与实验1,可知两实验的起始浓度相同,反应温度不同,达平衡时实验4中A的浓度小,说明了实验4中A进行的程度大,即温度越高,A的转化率越大,说明正反应为吸热反应。