教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
| ② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

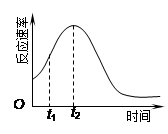
(1) 该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 - (填实验序号)。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),
则在2 min末,c(MnO4-)= mol/L。
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。
(4)小组同学发现反应速率总是如右图,其中t1~t2时间内速 率变快的主要原因可能是:①该反应放热、② 。
(1)浓度 ②>①
(2)0.0052
(3)KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间
(4)产物Mn2+(或MnSO4)是反应的催化剂
题目分析:(1)从题中可以看出H2C2O4溶液的浓度不同,KMnO4溶液而的浓度相同,说明该实验探究的是浓度对对化学反应速率的影响,并且浓度越大,反应速率越快,相同时间内针筒中所得CO2的体积为②>①;(2)中,在2 min末收集了4.48 mL CO2(标准状况下),即得到了0.0002mol CO2,根据2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可知,消耗了0.00004mol MnO4-,则剩下的
(30*0.010/1000)-0.00004=0.00026mol,所以c=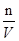 =
= mol/L=0.0052 mol/L;(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率;(4)刚开始反应的时候,速率并不快,但是后来逐渐加快,这可能是由于反应放热,或者是生成了具有催化作用的物质,例如Mn2+(或MnSO4)。
mol/L=0.0052 mol/L;(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率;(4)刚开始反应的时候,速率并不快,但是后来逐渐加快,这可能是由于反应放热,或者是生成了具有催化作用的物质,例如Mn2+(或MnSO4)。
点评:该题考查了影响化学反应速率的原因,是一道综合题,这有利于提高学生的综合分析能力,但是该题的难度不大,只有最后一个空有点难度,考生在解答这个空时,要联想到催化剂的作用就可以迎刃而解。
