(14分)在2L带气压计的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:
2X(g)+Y(g) 2Z(g);△H<0若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。
2Z(g);△H<0若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。
(1)平衡时Z的物质的量为___________;若反应经历5min达到平衡,则Y的平均反应速率为____________。
(2)相同条件下进行反应,在t1时刻,只改变下列某一种条件,其曲线图像如图甲。
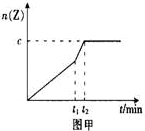
A.升温 B.降温 C.加压 D.减压 E.加催化剂
若c=0.90mol,t1时刻改变的条件是_________(填选项编号,下同),t2_______5min (填“>”,“<”或“=”下同)。
(3)若其他条件不变,原容器为恒压容器,达到平衡后Z的物质的量______0.9mol (填“>”,“<”或“=”)。
(4)若将物质的量均为3.00mol物质X、Y混合于5L容器中发生反应,在反应过程中Z的物质的量分数随温度变化如图乙。
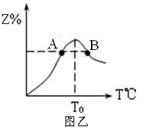
①A、B两点Z物质正反应速率的大小关系是_________;
②温度T<T0时,Z%逐渐增大的原因是______________。
(1)0.9mol (2分) 0.045 mol・L-1・min-1(2分)
(2)E(2分); < (2分)
(3)>(2分)
(4)①B>A;(2分)
②反应未达到平衡,反应仍在向正反应方向进行,故Z%的逐渐增大。(2分)
题目分析:
(1) 2X(g)+Y(g) 2Z(g)
2Z(g)
n(始) 2mol 1mol 0 mol
n(变) 2a mol a mol 2a mol
n(终) 2-2a mol 1-a mol 2a mol
3×0.85="2-2a+1-a+2a" ;所以a="0.45" ,平衡时Z的物质的量=2a=0.9mol;Y的反应速率=0.45/(5×2)= 0.045 mol・L-1・min-1。
(2) 只是减少了反应达到平衡的,所以应是加入了催化剂。时间应小于原来的5分钟。
(3) 恒压后,原反应发生过程中,气体体积减小,所以容器体积也在减小,而若为恒容,气体体积减小,压强减小,不利于反应向正向反应,所以恒压后,Z的物质的量大于0.9mol;
(4) ①B点的温度高于A点,温度升高,反应速率增大。
②Z还未达到平衡状态,正反应速率大于逆反应速率,平衡正向反应。所以Z的百分含量会不断升高。
点评:本题计算难度不大,属于常规计算。后面的识图分析,要抓住温度对反应速率的影响。
