某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题:
(1)已知:2H2O2(aq) =" 2" H2O (l) + O2(g) 的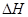 < 0, 则该反应的逆反应能否自发进行? (填“能”或“不能”),判断依据是 。
< 0, 则该反应的逆反应能否自发进行? (填“能”或“不能”),判断依据是 。
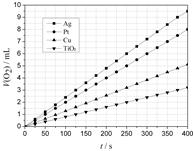
(2)某同学选用Ag、Pt、Cu、TiO2作为催化剂,在25℃ 时,保持其它实验条件相同,测得生成的O2体积(V)。V与分解时间(t)的关系如图所示(O2的体积已折算成标准状况),则:在不同催化剂存在下,H2O2分解反应的活化能大小顺序是 Ea( ) > Ea( ) > Ea( ) > Ea( ) (括号内填写催化剂的化学式)金属Pt 催化下,H2O2分解的反应速率v(O2) = mol·s-1
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。然后保持其它初始条件不变,改变温度T,重复上述实验。获得V(O2) ~ T关系曲线。下列趋势图最可能符合实测V(O2) ~ T关系曲线的是 ,原因是 。
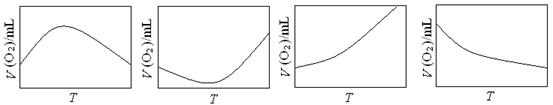
A.
B.
C.
D.
(4)以Pt为电极电解H2O2也可产生氧气,写出H2O2水溶液电解过程中的电极反应式(已知:H2O2的氧化性及还原性均比H2O强):阴极;阳极 。
(1)不能 (1分)
逆反应的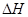 > 0,
> 0,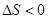 ,因此在任何温度下都不能自发进行 (2分)
,因此在任何温度下都不能自发进行 (2分)
(2)①Ea(TiO2) > Ea(Cu) > Ea(Pt) > Ea(Ag) (2分)
② 8.9×10-7 (2分)
(3)C (2分)
因该反应是不可逆反应,不考虑温度对平衡移动的影响。温度升高反应速率加快,因而经过相同反应时间后测得的O2体积随温度升高而增大 (2分)
(4)H2O2 + 2H+ + 2e- = 2H2O (2分,其它合理答案也给分)
H2O2 - 2e- = O2↑ + 2H+ (2分,其它合理答案也给分)
题目分析:
(1)该反应的逆反应是吸热的反应,并且还是熵减的方向,因此不能自发进行;逆反应的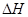 > 0,
> 0,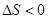 ,因此在任何温度下都不能自发进行
,因此在任何温度下都不能自发进行
(2)①从图上可以看出,在同一个时间点上,二氧化钛分解生成的氧气的量少,铜、铂、银依次增多,因此有:Ea(TiO2) > Ea(Cu) > Ea(Pt) > Ea(Ag)
② 反应速率是间位时间内浓度的变化量:8.9×10-7
(3)这个反应不是可逆反应,这个很重要,不考虑温度对平衡移动的影响。温度升高反应速率加快,因而经过相同反应时间后测得的O2体积随温度升高而增大。
(4)H2O2的氧化性及还原性均比H2O强,因此在两极得失电子都是双氧水了:
阴极:H2O2 + 2H+ + 2e- = 2H2O
阳极:H2O2 - 2e- = O2↑ + 2H+
