催化剂在生产和科技领域起到重大作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论________(填“合理”或“不合理”),理由是______________________。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
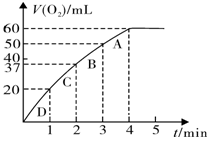
①实验时放出气体的总体积是 mL。
②放出1/3气体所需时间为 min。
③计算H2O2的初始物质的量浓度_____________。 (请保留两位有效数字)
④A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
⑤ 解释④反应速率变化的原因 ___ _____。
(共14分)
(1)产生气泡的快慢(2分), 不合理(2分) 阴离子种类不同(2分)
(2)产生40mL气体所需的时间(1分)
①60 mL (1分); ②1 min (1分) ;③ 0.11 mol·L-1(2分);
④D>C>B>A (1分); ⑤随着反应的进行,浓度减小,反应速率减慢 (2分)
题目分析:(1)甲中催化剂不同,则可以通过产生气泡的快慢定性比较得出结论。由于加入的盐中阴离子不同,所以不能通过观察甲中两支试管产生气泡的快慢,得出Fe3+和Cu2+对H2O2分解的催化效果。
(2)要比较外界条件对反应速率的影响,则需要测定产生40mL气体所需的时间来进行定量测定和计算。
(3)①根据图像可知,实验时放出气体的总体积是60ml。
②放出1/3气体大约是20ml,所需时间为1min。
③最终生成氧气的体积是60ml,物质的量是0.06L÷22.4L/mol=0.0027mol
双氧水分解的方程式是
2H2O2=2H2O+O2↑
2mol 1mol
0.0054 0.0027
所以双氧水的浓度是0.0054mol÷0.05L=0.11 mol·L-1
④反应速率越快,斜率越大,则A、B、C、D各点反应速率快慢的顺序为D>C>B>A。
⑤由于随着反应的进行,反应物浓度逐渐减小,反应速率减慢。
点评:该题是中等难度的试题,试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养。有利于培养学生规范严谨的实验设计能力,有助于提升学生的学科素养。解答时须理清化学反应速率与催化剂间的关系以及速率与图象间的关系。
