为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图1、2所示的实验。请回答相关问题。
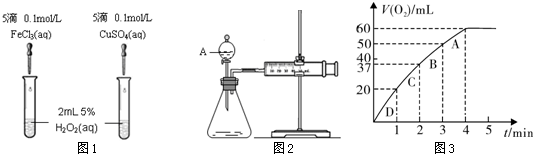
(1)定性分析:如图1可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为0.05 mol/L Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如图2所示,实验时均生成40 mL气体,其它可能影响实验的因素均已忽略。实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式 。
②实验时放出气体的总体积是 mL。
③A、B、C、D各点反应速率快慢的顺序为: > > > 。
解释反应速率变化的原因 。
④H2O2的初始物质的量浓度是 (请保留两位有效数字)。
(1)产生气泡的快慢(1分);消除阴离子不同对实验的干扰(1分)
(2)产生40 mL气体所需的时间(1分)
(3)①2H2O2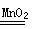 2H2O+O2↑(1分) ②60(1分)
2H2O+O2↑(1分) ②60(1分)
③D C B A(1分);随着反应的进行,H2O2浓度减小,反应速率减慢(1分)
④0.11 mol/L(1分)
题目分析:⑴该反应中产生气体,所以可根据生成气泡的快慢判断;氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用;硫酸钠和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,答案为:两支试管中产生气泡的快慢;消除阴离子不同对实验的干扰;
⑵仪器名称分液漏斗,检查气密性的方法:关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位;该反应是通过生成气体的反应速率分析判断的,所以根据v=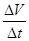 知,需要测量的数据是产生40ml气体所需要的时间,答案为:分液漏斗,关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位;产生40ml气体所需要的时间。
知,需要测量的数据是产生40ml气体所需要的时间,答案为:分液漏斗,关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位;产生40ml气体所需要的时间。
⑶从曲线的斜率可排知,反应速率越来越小,因为反应速率与反应物浓度成正比,随着反应的进行,反应物浓度逐渐降低,反应速率逐渐减小;
)①在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2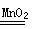 2H2O+O2↑;
2H2O+O2↑;
②根据图象知,第4分钟时,随着时间的推移,气体体积不变,所以实验时放出气体的总体积是60 mL;
③根据图象结合v=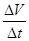 知,A、B、C、D各点反应速率快慢的顺序为D>C>B>A;
知,A、B、C、D各点反应速率快慢的顺序为D>C>B>A;
反应速率与反应物浓度成正比,随着反应的进行,反应物浓度逐渐降低,反应速率逐渐减小,
④设双氧水的物质的量为x,
2H2O2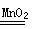 2H2O+O2↑
2H2O+O2↑
2mol 22.4L
x 0.06L
x=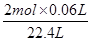 =0.0054mol,
=0.0054mol,
所以其物质的量浓度=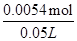 ="0.11" mol·L-1,故答案为:0.11 mol·L-1.
="0.11" mol·L-1,故答案为:0.11 mol·L-1.
