(1)已知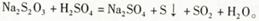 甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为l0mL):
甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为l0mL):

其他条件不变时:探究温度对化学反应速率的影响,应选择实验_______(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时问,可探究_____对化学反应速率的影响。
(2)某同学设计如下实验流程探究Na2S2O3的化学性质。
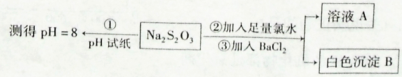
用离子方程式表示Na2S2O3溶液具有碱性的原因_______,实验操作①中测试时pH试纸的颜色应该接近 _______。
A.红色
B.深蓝色
C.黄色
D.绿色上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的______性。
(1)①⑤或②④ 比较改变不同反应物浓度对反应速率的影响;(2)S2O32-+H2O HS2O3-+OH- D 还原
HS2O3-+OH- D 还原
题目分析:(1)若要探究温度对化学反应速率的影响,应该是只改变温度,而其他条件不变。可选择实验组合为①⑤或②④.由于 实验①、实验②、实验③的温度相同,只是反应物的浓度不同。测定混合液变浑浊的时问,可探究的是不同的反应物的浓度对化学反应速率的影响。(2)Na2S2O3是强碱弱酸盐。弱酸根离子发生水解反应,消耗水电离产生的H+,破坏了水的电离平衡,水继续电离直至达到新的平衡状态。由于整个溶液中c(OH-)>c(H+).所以溶液呈碱性。水解的两种方程式为:S2O32-+H2O HS2O3-+OH-。在溶液的pH=8时,pH试纸的颜色应该接近绿色。因此选项为D。因为Na2S2O3有还原性,氯水有氧化性,二者发生氧化还原反应:Na2S2O3+4Cl2+5H2O=2NaCl+2H2SO4+6HCl.产生SO42-。再加入BaCl2溶液时发生沉淀反应:SO42-+Ba2+="Ba" SO4↓。因此实验②、③的目的是为了探究Na2S2O3的还原性。2S2O3溶液的性质的知识。
HS2O3-+OH-。在溶液的pH=8时,pH试纸的颜色应该接近绿色。因此选项为D。因为Na2S2O3有还原性,氯水有氧化性,二者发生氧化还原反应:Na2S2O3+4Cl2+5H2O=2NaCl+2H2SO4+6HCl.产生SO42-。再加入BaCl2溶液时发生沉淀反应:SO42-+Ba2+="Ba" SO4↓。因此实验②、③的目的是为了探究Na2S2O3的还原性。2S2O3溶液的性质的知识。
