问题
选择题
某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是
H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol·L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol·L-1 | 0.010 | 0.010 | 0.020 |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
答案
答案:C
题目分析:该可逆反应两边气体系数相等,在恒容条件下,甲丙两容器为等效平衡,各物质的百分含量对应相等、后者各物质浓度均为前者的两倍。
反应:H2 + CO2 H2O + CO
H2O + CO
起始:0.01 0.01 0 0
反应 x x x x
平衡0.01-x 0.01-x x x
设H2反应了x,则根据平衡常数可知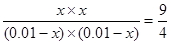 ,很容易计算出x=0.06,甲两容器中反应物的转化率为60%。乙相当于是在甲的基础上增加氢气的浓度,所以可以提高CO2的转化率,A正确;由于反应前后气体体积是不变的,因此甲和丙的平衡状态是等效的,但平衡时丙中c(CO2)=2×(0.010-0.010x)=0.008 mol/L,B正确,C不正确;丙中反应物的浓度最大,反应速率最快,D正确,答案选C。
,很容易计算出x=0.06,甲两容器中反应物的转化率为60%。乙相当于是在甲的基础上增加氢气的浓度,所以可以提高CO2的转化率,A正确;由于反应前后气体体积是不变的,因此甲和丙的平衡状态是等效的,但平衡时丙中c(CO2)=2×(0.010-0.010x)=0.008 mol/L,B正确,C不正确;丙中反应物的浓度最大,反应速率最快,D正确,答案选C。
