(1)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.①由图中所给数据进行分析,该反应的化学方程式为______;
②反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=______,
③当反应进行了3min,该反应是否达到平衡______(填“是”或“否”).
(2)把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现H2生成的速率变化情况如图,其中T1~T2速率变化的主要原因是______,
T2~T3速率变化的主要原因是______.
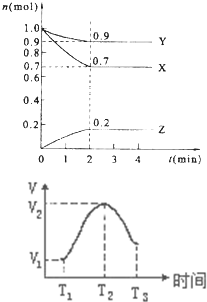
(1)①由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,
当反应进行到2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,
则△n(X):△n(Y):△n(Z)=3:1:2,参加反应的物质的物质的量之比等于化学计量数之比,
则反应的方程式为:3X+Y
2Z,故答案为:3X+Y
2Z;
②反应开始至2min末,Z的反应速率为:v=
=△c △t
=0.05mol/(L?min),0.2mol 2L 2min
故答案为:0.05mol/(L?min);
③3min后,各物质的物质的量不再发生变化,说明反应达到平衡状态,故答案为:是;
(2)金属镁与酸的反应为放热反应,反应开始时,温度不断升高,则反应速率逐渐增大,但随着反应的极性,反应物的浓度逐渐降低,此时浓度的影响大于温度的影响,反应速率反而减小,
故答案为:反应放热溶液温度升高反应速率增大;溶液中H+的浓度逐渐减小反应速率减小.
