问题
填空题
在体积为2L的密闭容器中,CO与H2在一定条件下反应生成甲醇:
CO(g)+2H2(g)

CH3OH(g).反应达到平衡时,平衡常数表达式K=______,升高温度,K值______(填“增大”、“减小”或“不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______.
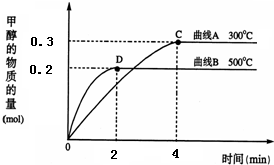
答案
因化学平衡常数等于生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积,所以K=
,由图可知,升高温度,甲醇的含量降低,平衡逆向移动,c(CH3OH) c(CO)c2(H2)
则化学平衡常数减小,由图象可知,在500℃时,2min到达平衡,甲醇的平均反应速率v(CH3OH)=
=0.05mol?(L?min)-1,由速率之比等于化学计量数之比求出,0.2mol 2L 2min
则v(H2)=2v(CH3OH)=2×0.05mol?(L?min)-1=0.1mol?(L?min)-1;
故答案为:
;减小;0.1mol?(L?min)-1.c(CH3OH) c(CO)c2(H2)
