硫及其化合物在化学工业中应用非常广泛.
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中______能导致光化学烟雾的形成;
目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化.
如:CO(g)+NO2(g)⇌NO(g)+CO2(g)△H=-akJ•mol-1(a>0)
2CO(g)+2NO(g)⇌N2(g)+2CO2(g)△H=-bkJ•mol-1(b>0)
则用标准状况下的3.36L CO还原NO2至N2(CO完全反应)的整个过程中放出的热量为______kJ(用含有a和b的代数式表示).
(2)工业上生产硫酸时,将SO2氧化为SO3是关键一步.
①某温度下,已知2SO2(g)+O2(g)⇌2SO3(g),△H=-196kJ•mol-1.开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),5分钟后反应达到平衡,共放出热量196kJ,该温度下此反应的平衡常数K=______,用O2表示的反应速率为______.
②一定条件下,向一带活塞的密闭容器中充入2mol SO2和1molO2,发生下列反应:2SO2(g)+O2(g)⇌2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是______(填字母).
A.保持温度和容器体积不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器内压强不变,充入1mol SO3
D.升高温度
E.移动活塞压缩气体
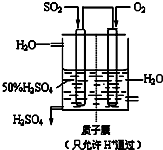
(3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式______.
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中氮氧化物是引起光化学烟雾的原因,故NO2能导致光化学烟雾的形成;
①CO(g)+NO2(g)⇌NO(g)+CO2(g)△H=-akJ•mol-1(a>0)
②2CO(g)+2NO(g)⇌N2(g)+2CO2(g)△H=-bkJ•mol-1(b>0)
①×2+②得到:4CO(g)+2NO2(g)⇌4CO2(g)+N2(g)△H=-(2a+b)kJ•mol-1
标准状况下的3.36L CO的物质的量═
=0.15mol;根据合并得到的热化学方程式可以计算得到标准状况0.15molCO还原NO2至N2(CO完全反应)的整个过程中放出的热量为:3.36L 22.4L/mol
=0.15mol×(2a+b) 4
(2a+b)KJ;3 80
故答案为:NO2;
;3(2a+b) 80
(2)①2SO2(g)+O2(g)⇌2SO3(g),△H=-196kJ•mol-1.开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),5分钟后反应达到平衡,共放出热量196kJ,消耗SO2的物质的量为2mol,根据化学平衡列式计算:
2SO2 +O2⇌2SO3,
起始量(mol) 4.0 5.0 0
变化量(mol) 2.0 1.0 2.0
平衡量(mol) 2.0 4.0 2.0
K=
=[SO3]2 [SO2]2•[O2]
=2.5 mol-1•L;(
)22 10 (
)2×2 10 4 10
v(O2)=
=0.02 mol•L-1•min-12mol 10L 5min
②A.保持温度和容器体积不变,充入2mol SO3,平衡向逆反应分析移动,则SO2、O2、SO3气体平衡浓度都比原来增大,故A正确;
B.保持温度和容器体积不变,充入2mol N2,对平衡移动没有影响,各物质的浓度不变,故B错误;
C.保持温度和容器内压强不变,充入1mol SO3,处于等效平衡状态,浓度不变,故D错误;
D.升高温度,平衡向逆反应分析移动,SO3的浓度减小,故E错误;
E.移动活塞压缩气体,体积减小,各物质的浓度都增大,故F正确.
故答案为:①2.5 mol-1•L; 0.02 mol•L-1•min-1; ②AE;
(3)原电池负极发生氧化反应,SO2被氧化生成SO42-,负极电极反应式为SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
