在体积为1L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)

CO(g)+H2O(g),反应焓变为△H,其化学平衡常数K和温度t的关系如下表:
| T℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的△H______零(选填“>”或“<”)
(2)能判断该反应是否达到化学平衡状态的依据是______
A.容器中压强不变
B.混合气体中c(CO)不变
C.V正(H2)=V逆(H2O)
D.c(CO2)=c(CO)
(3)若上述反应以CO和H2O蒸汽为起始反应物,在T℃时CO和H2O浓度变化如图所示,则0-4min的平均反应速率v(CO2)=______mol/(L-min),T=______℃.
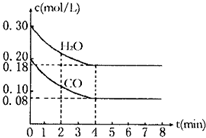
(1)由表中数据可知,温度升高,平衡常数增大,说明升高温度平衡向正反应移动,则正反应吸热,△H>0,
故答案为:>;
(2)A.由于气体反应前后的化学计量数不变,则无论是否达到平衡状态,压强都不变,所以容器中压强不变不能作为判断的依据,故A错误;
B.当达到化学平衡时,混合气体中c(CO)不变,故B正确;
C.V正(H2)=V逆(H2O),说明达到平衡状态,故C正确;
D.c(CO2)与c(CO)的大小关系取决于反应起始时的物质的量的多少,不能作为判断是否达到平衡的依据,故D错误,
故答案为:BC;
(3)化学反应速率之比等于化学计量数之比,
则0-4min的平均反应速率v(CO2)=v(CO)=
=0.03mol/(L?min),0.20mol/L-0.08mol/L 4min
平衡时各物质的浓度根据反应的化学方程式计算:
CO2(g)+H2(g)

CO(g)+H2O(g)
起始:0 0 0.2mol/L 0.3mol/L
转化:0.12mol/L 0.12mol/L 0.12mol/L 0.12mol/L
平衡:0.12mol/L 0.12mol/L 0.08mol/L 0.18mol/L
k=
=1.00.08mol/L×0.18mol/L 0.12mol/L×0.12mol/L
根据表中数据可知温度为850℃,
故答案为:0.03;850.
