在100℃时,将0.4mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
(2)n3______n4(填“>”、“<”或“=”),该反应的平衡常数的值为______;
(3)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是______mol/L.
(4)假设从放入N2O4到平衡时需要80s,请在右图中画出并标明该条件下此反应中N2O4浓度随时间变化的曲线.
(5)在(4)中条件下达到平衡后四氧化二氮的转化率为______,混合气体的平均摩尔质量为______g.mol-1.
(6)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2
N2O4的平衡常数将______(填“增大”、“减小”或“不变”)
(7)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡2NO2
N2O4将______.(填“向左移动”、“向右移动”或“不移动”).
(8)达到平衡后,如果缩小容器的体积,则气体的颜色变化是先变深后变浅,但比原来的颜色深,试用平衡移动原理解释其变化的原因______.

(1)由表中数据可知,,从反应开始直至20s时,v(N2O4)=
=0.00125mol•L-1•min-1,则v(NO2)=2v(N2O4)=2×0.00125mol•L-1•min-1=0.0025 mol•L-1•min-1,0.05mol 2L 20s
故答案为:0.0025 mol•L-1•min-1;
(2)反应达到60s时达到化学平衡状态,二氧化氮的物质的量不再变化,所以n3=n4,
根据反应方程式计算:
2NO2

N2O4
初始:0.4mol 0
转化:0.16mol 0.08mol
平衡:0.24mol 0.08mol
则平衡时的浓度分别为:c(N2O4)=0.04mol/L,c(NO2)=0.12mol/L,
k=
=c(N2O4) c2(NO2)
=2.8(mol/L)-1,0.04mol/L 0.12mol/L×0.12mol/L
故答案为:=;2.8;
(3)根据反应 2NO2

N2O4可知,0.4molNO2与0.2molN2O4相当,若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是
=0.1mol/L,故答案为:0.1mol/L;0.2mol 2L
(4)从放入N2O4到平衡时需要80s,初始加入的N2O4为0.2mol,物质的量浓度为0.1mol/L,图象可取20s,40s,80s等几个点用平滑曲线来连接,故答案为:
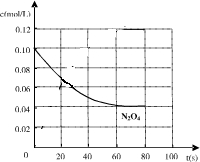
;
(5)根据等效平衡,在(4)中条件下达到平衡后四氧化二氮的物质的量为0.08mol,与充入二氧化氮为相同平衡状态,则反应的四氧化二氮的物质的量为0.2mol-0,08mol=0.012mol,所以转化率为:
× 100=60%,混合气体的平均摩尔质量与初始加入二氧化氮时混合气体的平均摩尔质量相等,0.012mol 0.2mol
=. M
=57.5g.mol-1,故答案为:60%;57.5g.mol-1;0.24mol×46g/moL+0.08mol×92g/mol 0.24mol+0.08mol
(6)升高温度,气体颜色会变深,说明升高温度平衡向左移动,平衡常数减小,故答案为:减小;
(7)向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,He为惰性气体,不参与反应,增大体积,对参加反应的气体来说,相当于是压强减小,则平衡左移,
故答案为:向左移动;
(8)缩小体积浓度增大,颜色加深,平衡向右移动,c(NO2)的浓度减小,但比原来的浓度要大,符合勒夏特列原理,
故答案为:缩小容器体积,压强增大,c(NO2)的浓度变大,颜色加深;增大压强,平衡正向移动,c(NO2)的浓度减小,但比原来的浓度要大,所以看到气体颜色先变深,后变浅,但比原来深.
