可知NO2和N2O4可以相互转化:2NO2(g)

N2O4(g);△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.回答下列问题:
(1)图象中的平衡点是: (用a、b、c、d填空).
(2)图中的两条曲线, 是表示N2O4浓度随时间的变化曲线(填“X”或“Y”).
(3)前10min内用υ(NO2)表示的化学反速率为 .
(4)25min时,导致平衡移动的原因是 .
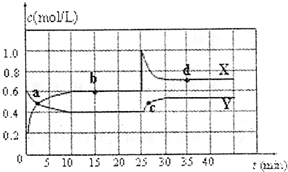
(1)由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故答案为:b、d;
(2)由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线,
故答案为:Y;
(3)X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线.由图可知,
前10min内,NO2的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,所以υ(NO2)=
=0.04mol•L-1•min-1,故答案为:0.04mol•L-1•min-1;0.4mol/L 10min
(4)25min时,生产物浓度增大,反应物浓度不变,只能是增大生产物的浓度,由(2)分析可知NO2是生成物,故为增大NO2的浓度,
故答案为:增大NO2的浓度.
