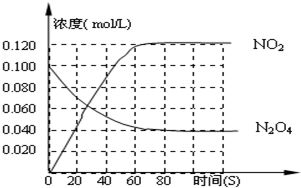
在一体积为1L的容器中,通入一定量的N2O4,在100℃时发生如下反应,N2O4

2NO2-Q(Q>0),其N2O4 和NO2 浓度变化如图如示.
(1)上述反应的平衡常数表达式为______,升高温度K值______(填“增大”、“减小”或“不变”)]
(2)在0-60s这段时间内,四氧化二氮的平均反应速率为______mol/L.s
(3)120℃时,在相同的容器中发生上述反应,容器内各物质的物质的量变化如图
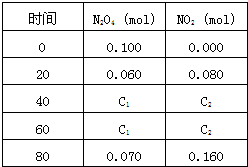
①该温度时,反应处于平衡状态的时间是______,C1的数值______0.04(填“大于”、“小于”或“等于”).
②反应在60-80s间平衡向逆反应方向移动,可能的原因是______
(A) 使用催化剂 (B) 减少N2O4的浓度
(3)减小体系压强 (D) 增加NO2的浓度.
(1))化学平衡常数指生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,所以,该反应平衡常数k=
;[c(NO2)]2 c(N2O4)
该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应移动,所以平衡常数k值增大.
故答案为:
;增大;[c(NO2)]2 c(N2O4)
(2)由图可知,在0-60s这段时间内,四氧化二氮的浓度变化量为(0.1mol/L-0.04mol/L)=0.06mol/L,
60s内,四氧化二氮的平均反应速率v(N2O4)=
=0.001mol/(L•s).0.06mol/L 60s
故答案为:0.001mol/(L•s);
(3)①由表知,40s、60s时N2O4的浓度不变、NO2的浓度不变,说明从40s~60s处于平衡状态;
两个温度下,开始四氧化二氮的浓度都为0.1mol/L,由(1)中图可知,100℃时反应到达平衡,四氧化二氮的浓度为0.04mol/L,该反应为吸热反应,升高温度,平衡向吸热反应方向移动,即向正反应移动,四氧化二氮的浓度减小,即C1小于0.04mol/L,故答案为:40s~60s;小于;
②反应在60-80s间平衡向逆反应方向移动,
(A) 使用催化剂,不影响平衡移动,故A错误;
(B) 减少N2O4的浓度,平衡向逆反应移动,结合由(1)中图可知,平衡时四氧化二氮的浓度应小于0.04mol/L,比C1还要小,故B错误;
(C)减小体系压强 平衡向体积增大方向移动,即向正反应移动,故C错误;
(D)增加NO2的浓度,平衡向逆反应进行,四氧化二氮的浓度增大,故D正确;
故答案为:D.
