向200mL 6mol•L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准 状况下测定).
请回答下列问题:
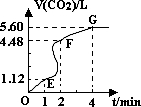
(1)设OE段的反应速率为υ1,EF段的反应速率为υ2,FG段的反应速率为υ3,则υ1、υ2、υ3从大到小的顺序为______.
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是______(填字母).
A、蒸馏水 B、氯化钾固体 C、氯化钠溶液 D、浓盐酸
(3)加入CaCO3的质量为______.
(4)若反应过程中溶液体积的变化忽略不计,则EF段用盐酸表示的化学反应速率υ(HCl)=______.
(1)从图象可知,单位时间内生成的气体EF段>OE段>FG段,单位时间内生成气体的体积越大,反应速率越大,则
v2>v1>v3,故答案为:v2>v1>v3;
(2)A、加入蒸馏水,溶液的浓度减小,反应速率减小,故A正确;
B、氯化钾固体对溶液的浓度无影响,且KCl不参加反应,所以速率不变,故B错误;
C、加入氯化钠溶液,减小盐酸的浓度,反应速率减小,故C正确;
D、加入浓盐酸,盐酸的浓度增大,反应速率增大,故D错误,
故答案为:AC.
(3)当反应进行到4min时,生成气体的体积不变,说明碳酸钙完全反应,
则有:CaCO3+2HCl═CaCl2+CO2↑+H2O,
100g 22.4L
x 5.60L
则有:x=
=25g,100g×5.60L 22.4L
故答案为:25g.
(4)EF段生成二氧化碳的体积为4.48L-1.12L=3.36L,
CaCO3+2HCl═CaCl2+CO2↑+H2O
2mol 22.4L
n 3.36L
则:n=
=0.3mol,2mol×3.36L 22.4L
消耗盐酸的浓度为c(HCl)=
=1.5mol/L,0.3mol 0.2L
所以EF段用盐酸表示的化学反应速率v(HCl)=
=1.5mol•L-1•min-1,1.5mol/L 1min
故答案为:1.5mol•L-1•min-1.
