工业制硝酸的主要反应是:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)+Q;Q>0
(1)该反应的平衡常数表达式为______,升高温度K值______(填“增大”、“减小”或“不变”)
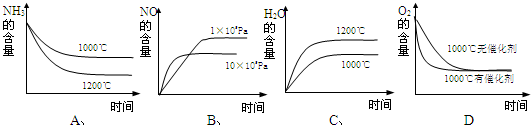
(2)若反应起始的物质的量相同,下列关系图错误的是______(填序号)
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
②反应在第2min时改变了条件,改变的条件可能是______(填序号)
A、使用催化剂 B、升高温度
C、减小压强 D、增加O2 的浓度
③在第6min时,改变了反应的条件,该平衡向______移动(填“左”或“右”).
(1)依据反应化学方程式,4NH3(g)+5O2(g)=4NO(g)+6H2O(g),结合平衡常数概念列式得到,K=
;反应是放热反应,升温,平衡逆向进行平衡常数减小;c4(NO)c6(H2O) c4(NH3)c5(O2)
故答案为:
;减小;c4(NO)c6(H2O) c4(NH3)c5(O2)
(2)A、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以氨气的转化率减小,氨气的含量增大,故A错误;
B、该反应是气体体积增大的反应,增大压强平衡向气体体积减小的方向移动,即正反应方向移动,所以NO的含量增大,故B正确;
C、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以水的含量减小,故C错误;
D、催化剂只改变反应到达平衡的时间,对化学平衡无影响,故D正确.
故答案为:AC;
(3))①氨气的平均化学反应速率为v=
=△c △t
=0.015 mol/L.min,同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以氧气的平均化学反应速率为0.1875mol/L.min.(0.6000-0.3000)mol/L 2min
故答案为:0.1875;
②通过图表比较起始到第2min和第2min到第4min时知,反应物和生成物的反应速率都增大,所以改变的条件是升高温度或使用催化剂;AB正确,C是减小压强速率减小,C错误;D图表中计算得到2min氧气浓度为1.6mol/L-0.25mol/L=1.35mol/L;变化后压强浓度减小,故D错误;
故答案为:AB;
③通过图表知,反应物浓度增大,生成物浓度减小,所以平衡向逆反应方向移动,即向左移动.故答案为:左.
