问题
计算题
将对H2相对密度为3.6 的N2与H2组成的混合气0.5 mol 通入一恒容密闭容器中,一定条件下发生反应,平衡时容器内压强比反应前少了24%。求:
(1) 反应前混合气中N2和H2的质量比。
(2) 平衡混合气中,含氨的体积分数。
(3) 平衡时N2、H2的转化率。
答案
(1)7∶2(2)31.6%。
(3)N2、H2的转化率分别为60%和40%。
这种题首先要利用相对密度求出混合气的平均相对分子量为 7.2,利用十字交叉法求出N2、H2的物质的量比为1∶4,从而得出N2、H2的质量比为 7∶2。然后设未知数列出下列平衡计算模式:
N2(g) + 3H2(g) 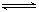 2NH3(g)
2NH3(g)
n 0(mol) 0.4 + 0.1 + 0 = 0.5
n变(mol) 3x x 2x
n平(mol) 0.4-3x + 0.1-x + 2x = 0.5-2x
根据压强与物质的量成正比,可得出2x = 0.12 mol,即可求出NH3的体积分数为31.6%。最后可求出N2、H2的转化率分别为60%和40%。
