问题
选择题
反应A+3B=2C+D在四种不同情况下的反应速率分别为:
①v(A) =0.15mol/(L·s) ②v(B)=0.6mol/(L·s)③v(C)=0.5mol/(L·s) ④v (D) =0.45mol/(L·s)
则反应进行由快到慢的顺序为:
A.④>③>①>② B.②>④>③>①
C.②>③>④>① D.④>③>②>①
答案
答案:D
同一化学反应方程式中,不同物质表示该反应的反应速率数值可能不同,但表示的意义完全相同,都是表示该反应的反应速率。并且,在同一化学反应方程式中,不同物质的速率之比等于化学计量数之比,所以,比较同一反应的反应速率快慢,需要将反应速率转化为同一种物质的反应速率才能比较;假设均将反应速率转化为v(B)的反应,则
①v(A)=3 v(B)=0.15mol/(L·s),得v(B)=0.05mol/(L·s);③v(C)=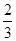 v(B)=0.5mol/(L·s),得
v(B)=0.5mol/(L·s),得
v(B)=0.75mol/(L·s);④v (D) =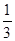 v(B)=0.45mol/(L·s),得v(B)=1.35mol/(L·s);
v(B)=0.45mol/(L·s),得v(B)=1.35mol/(L·s);
所以,正确的关系为:④>③>②>①
