(16分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g)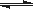 Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的?H = 。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是 。
A.焦炭的质量不再变化 B.N2和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是 。
A.升高温度 B.降低压
C.加入更多的SiO2 D.充入N2
某温度下,测得该反应中N2和CO各个时刻的浓度如下,
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度/mol·L-1[ | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol·L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | — | — | — |
(1)?H =-1591.2KJ/mol(2)ACD(3)BD
(4)3.70×10-2 mol·L-1·min-1 81.0 mol·L-1
(1)?H =132.6kJ/mol ×12=-1591.2KJ/mol(2)ACD正确,B不正确,速率比等于计量数之比(3)BD 正确,A、升温平衡向吸热的方向移动,逆向移动;C、不正确,SiO2是固体,加SiO2不能改变反应物的浓度。
(4)v(N2)="(" 4.00-3.26) mol·L-1/20mim=3.70×10-2 mol·L-1·min-1
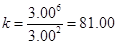 ,k为81.0 mol·L-1
,k为81.0 mol·L-1
