(10分)
某课外兴趣小组探究铝与盐酸反应的反应速率与哪些因素有关。请填写下列空白:
(1)实验化学反应原理: 。
(2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、水槽、;稀盐酸(4mol/L)、铝条(片)、水、胶头滴管、温度计。
(3)实验装置(图中铁架台等夹持仪器略去)
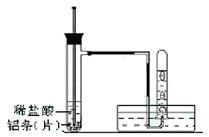
(4)实验方法
①按如图所示连接好实验仪器,检查装置的气密性
②取3块铝条(足量)加入到试管中。
③在盛有铝条的试管中,加入2mL稀盐酸。
④测量试管中溶液的温度。
⑤收集反应产生的氢气。
(5)数据处理及问题讨论
①实验结束后,课外兴趣小组成员将产生氢气的体积与时间作了如下的图。
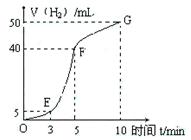
②试判断OE、EF、FG段所收集气体的多少。
OE: ;EF: ;FG: 。
写出这三段时间内产生氢气的速率大小比较(用OE、EF、FG 表示),并解释原因。
速率大小比较: 。原因:________
③如果反应太激烈,为了减缓反应速率而又不减少产生氢气
的量,他在盐酸中分别加入下列溶液:
A.蒸馏水
B.NaCl溶液
C.Na2CO3溶液
D.CuSO4溶液 E. NaNO3溶液你认为可行的是(填编号) 。
(10分)
(1)2Al+6HCl=2AlCl3+3H2↑(2分,化学式有错者得0分,未配平者扣1分。不标气体符号的扣1分)
(5)②5mL; 35mL;10mL。(各1分,共3分;顺序错者不给分)
速率大小比较:EF>FG>OE。(1分)
原因:该反应是放热反应,随着温度的升高,反应速率增大,一段时间后,随着反应物的浓度的减小,反应速率减小。(2分)
③A、B (2分,有错选不给分,漏选一个扣1分)
