问题
计算题
在一个容积为500毫升的密闭容器中,充入5molH2和2molCO,在一定温度和一定压强下发生如下反应:2H2(g )+CO(g)  CH3OH(g),经过5分钟后达到平衡状态,若此时测得CH3OH蒸汽的浓度为2mol/L,求:
CH3OH(g),经过5分钟后达到平衡状态,若此时测得CH3OH蒸汽的浓度为2mol/L,求:
(1)以H2的浓度变化表示的该反应的速率;
(2)达到平衡时CO的转化率;
(3)该温度下的K
答案
(1)0.8mol/(L·min) (2)50% (3)1/36
平衡时生成CH3OH蒸汽的浓度为2mol/L,即物质的量为1mol。
2H2(g )+CO(g)  CH3OH(g)
CH3OH(g)
起始量(mol) 5 2 0
转化量(mol) 2 1 1
平衡量(mol) 3 1 1
所以以H2的浓度变化表示的该反应的速率为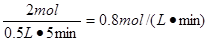 。
。
到平衡时CO的转化率50%。
该温度下的平衡常数为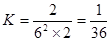 。
。
