问题
计算题
某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)  2NH3(g);在2 min时达到平衡状态,此时c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。
2NH3(g);在2 min时达到平衡状态,此时c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。
试求:(1)该温度下反应的平衡常数
(2)H2的起始浓度
(3)用N2表示该反应的平均反应速率
(4)N2的转化率
答案
(1)K = 5×10-3mol-2·L2
(2)C0(H2) =" 17.5" mol·L-1
(3)v(N2) =" 1.25" mol·L-1·min-1
(4)α(N2) = 33.3%
由“三段式”求解
反应: N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
初c: 7.5 17.5 0
△c: 2.5 7.5 5
平衡c: 5 10 5
(1)K=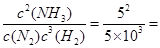 5×10-3mol-2·L2
5×10-3mol-2·L2
(2)C0(H2) =" 17.5" mol·L-1
(3)v(N2) =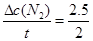 ="1.25" mol·L-1·min-1
="1.25" mol·L-1·min-1
(4)α(N2) =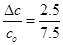 = 33.3%
= 33.3%
