工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l) CH3COOC2H5(l)+H2O(l) ΔH=-8.62kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-8.62kJ·mol-1
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。
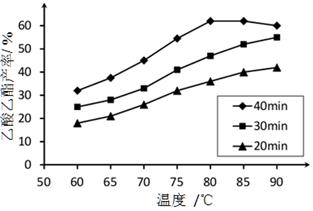
(1)该研究小组的实验目的是__________________。
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率___________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是______(写出两条)。
(4)某温度下,将0.10 mol CH3COOH溶于水配成1 L溶液。
①实验测得已电离的醋酸分子占原有醋酸分子总数的1.3%,则该温度下CH3COOH的电离平衡常数K=____________________。(水的电离忽略不计,醋酸电离对醋酸分子浓度的影响忽略不计)
②向该溶液中再加入__________mol CH3COONa可使溶液的pH约为4。(溶液体积变化忽略不计)
(10分)
(1)探究反应温度、反应时间对乙酸乙酯产率的影响 (2分)
(自变量、因变量有遗漏或表达不清,扣1分)
(2)小于(2分)(“<”得1分)
(3)反应可能已达平衡状态,温度升高平衡向逆反应方向移动;温度过高,乙醇和乙酸大量挥发使反应物利用率下降(2分)
(4)①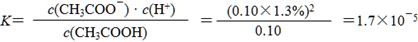 (2分)
(2分)
(因计算时未作近似处理使小数在1.69~1.71之间均不扣分)
②1.7×10-2 (2分)
(“1.69×10-2~1.71×10-2”或用小数表示均不扣分)
题目分析:(1)根据图中信息可以得出此实验的目的是探究反应温度、反应时间对乙酸乙酯产率的影响。
(2)温度越高,反应速率越大,故前者的平均反应速率小于后者。
(3)ΔH=-8.62kJ·mol-1,即反应为放热反应,达到平衡时化学反应逆向移动。故乙酸乙酯产率下降的原因可能是反应可能已达平衡状态,温度升高平衡向逆反应方向移动;温度过高,乙醇和乙酸大量挥发使反应物利用率下降。
(4)①经过公式计算得: 。
。
点评:本题考查的是化学反应速率的影响因素、化学平衡移动和电离平衡常数计算的知识,题目难度较大,考查学生对基础知识的掌握和计算的能力。
