反应A(g) 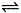 B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
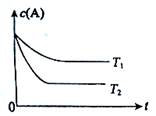
(1)上述反应的温度T1 T2,平衡常数K(T1) K(T2)。(填“大于”、“小于” 或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为 。
②反应的平衡常数K= 。
③反应在0~5min区间的平均反应速率v(A)= 。
(1)小于 小于 (2)①0.085mol ②0.082mol/L ③0.007mol/(L·min)
(1)图中显示,T2时达到平衡所用时间少,反应速率大所以温度高;而温度越高c(A)越小,说明升温反应向正反应方向移动,则正反应为吸热反应,升温K将增大。
(2)根据反应: A(g)  B(g) +C(g)
B(g) +C(g)
反应前:(mol/L) 0.050 0 0
转化量:(mol/L) 0.035 0.035 0.035
平衡时:(mol/L) 0.015 0.035 0.035
则①平衡时体系总的物质的量为(0.015+0.035+0.035)mol/L×1L=0.085mol。
②反应的平衡常数K=c(B)c(C)/c(A)=(0.035 mol/L)2/0.015 mol/L =0.082mol/L。
反应在0~5min区间的平均反应速率v(A)= (0.035 mol/L)/5min=0.007mol/(L·min)。
【考点定位】本题考查化学反应速率和化学平衡。
