在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
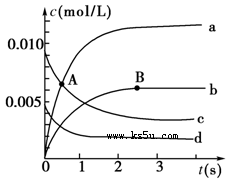
(1)A点处,v(正)________v(逆),A点正反应速率________B点正反应速率(用“大于”、“小于”或“等于”填空)。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(1)大于 大于 (2)b 1.5×10-3mol/(L·s) (3)bc (4)bcd
题目分析:(1)NO是反应物,起始浓度是0.020mol÷2L=0.010mol/L,所以曲线c表示NO的浓度变化曲线。A点NO的浓度继续降低,没有达到平衡状态,反应仍然是向正反应方向进行的,正反应速率大于逆反应速率,所以A点正反应速率大于B点正反应速率。
(2)NO2是生成物,在反应过程中浓度是增大的。由表中数据可知,平衡时c(NO)=0.007mol/L÷2L=0.0035mol/L。曲线b平衡时的浓度为0.0035mol/L,根据反应方程式中的化学计量数可知,曲线b表示NO2的浓度变化曲线。反应进行到2s是,NO浓度减少了0.010mol/L-0.004mol/L=0.006mol/L,所以氧气的浓度变化量是0.003mol/L,则氧气的反应速率是0.0030mol/L÷2s=1.5×10-3mol/(L·s)。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.始终都存在v(NO2)=2v(O2)关系,故不能说明到达平衡,故a错误;b.随反应进行气体的物质的量减小,压强逐渐减小,因此容器内压强保持不变时,可以说明到达平衡,故b正确;c.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v逆(NO)=2v正(O2),可以说明到达平衡,故c正确;d.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,故d错误,答案选bc。
(4)a.及时分离出NO2气体,平衡向正反应移动,但反应速率降低,故a错误;b.适当升高温度,反应速率增大,平衡向逆反应移动,故b正确;c.增大O2的浓度,反应速率增大,平衡向正反应移动,故c正确;d.选择高效的催化剂,增大反应速率,不影响平衡移动,故d正确,答案选bcd。
点评:该题是高考中的常见题型,属于中等难度的试题,试题贴近高考,基础性强,侧重对学生能力的培养,有利于调动学生的学习兴趣,有助于培养学生的逻辑推理能力和创新思维能力。难点是平衡状态的判断,答题时应注意平衡状态判断选择判断的物理量,应随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
