问题
填空题
在2升容器中加入18g水蒸气,28g一氧化碳,在t℃时(t>100),发生如下反应:
CO+H2O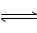 CO2+H2,在最初5秒钟内,一氧化碳的平均反应速率是0.02 mol·l-1·s-1求:
CO2+H2,在最初5秒钟内,一氧化碳的平均反应速率是0.02 mol·l-1·s-1求:
(1) 5秒钟末,容器内CO2和H2O蒸汽浓度分别为________,__________。
(2) 若设计此反应为一个原电池,则负极发生________反应(填“氧化”,“还原”),负极消耗的物质化学式为____________。
答案
(1) 0.1mol/L,0.4mol/L (2) 氧化,CO
题目分析:(1)水蒸气和CO的物质的量分别都是1mol
在最初5秒钟内,一氧化碳的平均反应速率是0.02 mol·l-1·s-1
则消耗CO的浓度是0.02 mol·l-1·s-1×5s=0.1mol/L
所以根据方程式可知5秒钟末,容器内CO2和H2O蒸汽浓度分别为0.1mol/L、0.5mol/L-0.1mol/L=0.4mol/L
(2)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式可知,CO是还原剂失去电子,水蒸气是氧化剂,得到电子,所以负极消耗的是CO,发生的是氧化反应。
点评:该题是基础性试题的考查,难度不大。试题贴近教材,基础性强。该题的关键是明确反应速率的含义以及原电池的工作原理,然后结合题意灵活运用即可,有利于调动学生的学习兴趣和学习积极性。
