固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)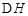 =-49.0kJ·mol
=-49.0kJ·mol
某科学实验小组将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
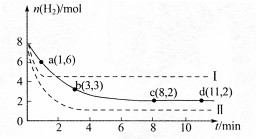
(1)该反应在0~8min内CO2的平均反应速率是 mol·L-1·min-1
(2)此温度下该反应的平衡常数K的数值为 。
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。
与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是 。若实线对应条件下平衡常数为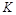 ,曲线Ⅰ对应条件下平衡常数为
,曲线Ⅰ对应条件下平衡常数为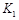 ,曲线Ⅱ对应条件下平衡常数为
,曲线Ⅱ对应条件下平衡常数为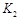 ,则
,则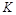 、
、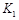 和
和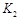 的大小关系是 。
的大小关系是 。
(10分)
(1)0.125(2分)
(2)0.5mol-2·L-2 (2分,单位不写扣分)
(3)升高温度(2分);增大压强(2分);K1<K2=K(2分);
题目分析:
(1)该反应在0~8min内H2的平均反应速率是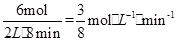 ,根据速率之比等于计量数之比CO2的平均反应速率是0.125 mol·L-1·min-1
,根据速率之比等于计量数之比CO2的平均反应速率是0.125 mol·L-1·min-1
(2)平衡常数K=;
(3)曲线Ⅰ,结合反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)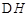 =-49.0kJ·mol,改变的条件升高温度使到达平衡所需时间缩短但氢气的转化率下降;曲线Ⅱ改变的条件增大压强使到达平衡所需时间缩短,由于平衡正向移动,与原平衡相比n(H2)减少;K只与温度有关,
=-49.0kJ·mol,改变的条件升高温度使到达平衡所需时间缩短但氢气的转化率下降;曲线Ⅱ改变的条件增大压强使到达平衡所需时间缩短,由于平衡正向移动,与原平衡相比n(H2)减少;K只与温度有关,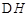 <0的反应。温度越高,K越小,所以K1<K2=K。
<0的反应。温度越高,K越小,所以K1<K2=K。
