300℃时,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g) △H,2min末达到平衡,生成0.8mol D。
2C(g)+2D(g) △H,2min末达到平衡,生成0.8mol D。
(1)在2min末时,A的平衡浓度为_____________,B的转化率___________,0-2min内D的平均反应速率为_____________。
(2)该反应的平衡常数表达式为:K=_____________。该温度下的化学平衡常数数值为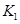 =____________。
=____________。
已知350℃时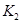 =l,则△H________0(填“>”或“<”)。
=l,则△H________0(填“>”或“<”)。
(3)在300℃时,将该反应容器压缩体积为lL。则A的转化率___________(填“增大”、“减小”或“不变”),原因是__________________。该条件下的平衡常数为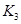 。 则K3________
。 则K3________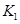 ,(填“<”或“>”或“=”)。原因是_______________________。
,(填“<”或“>”或“=”)。原因是_______________________。
(4)能判断该反应是否达到化学平衡状态的依据是__________________(多选扣分)。
A.容器中压强不变 B.混合气体中c(A)不变
C.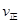 (A)=
(A)=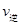 (C) D.混合气体密度不变
(C) D.混合气体密度不变
(1)0.4mol∕L 20℅ 0.2 mol∕(L·min) (2)K={C2(C)C2(D) }∕{C3(A)C (B)} 0.5 >
(3)不变。增大压强。平衡不移动= K值只与温度有关 。 (4)B
题目分析:(1)根据反应方程式:3A(g)+B(g) 2C(g)+2D(g)可看出:反应时A 、B、C、D的物质的量的关系是3:1:2:2,因为生成0.8mol的D,所以消耗A1.2mol,消耗B0.4mol,生成C0.8mol。故A的平衡浓度为:(2-1.2)mol÷2L="0.4mol∕L" . B的转化率为:0.4mol÷2mol× 100%="20%," 0-2min内D的平均反应速率为V="ΔC∕" Δt="(0.8mol÷2L)" ∕2min=" 0.2" mol∕(L·min).(2)化学平衡常数是可逆反应达到化学平衡时各生成物浓度幂指数的积与各反应物浓度幂指数的积之K={C2(C)C2(D) }∕{C3(A)C (B)}。达到化学平衡时各物质的浓度分别是C(A)=" 0.4mol∕L" ;C(B)="(2-0.4)mol÷2L=0.8mol∕L" ;C(C)=" 0.8mol" ÷2L="0.4" mol∕L ;C(D)=" 0.8mol" ÷2L="0.4" mol∕L。所以化学平衡常数为:K1={(0.4)2×(0.4)2}∕{(0.4)3×0.8}=0.5.又因为在350℃时K2=l,可见升高温度,K增大,说明升高温度化学平衡向正反应方向移动。根据化学平衡移动原理:升高温度,化学平衡向吸热反应方向移动。即正反应是吸热反应。故△H>0.(3)将反应容器体积压缩,也就是增大压强。根据化学平衡移动原理:增大压强,化学平衡向气体体积减小的方向移动。而该反应是个反应前后气体体积相等的反应,所以增大压强。化学平衡不移动。这时A、B的转化刻率都不会发生变化。化学平衡常数只与温度有关。而与物质投料的多少及次数无关。所以K1=K3. (4)当反应达到化学平衡时各物质的浓度不变,用同一物质表示的正反应速率和逆反应速率相等,个物质的含量不变。由于容器的体积不变,该反应是个反应前后气体体积相等的反应,所以任何时刻压强不变,气体的密度也不变,故它们不能作为判断平衡的标志。正确选项为:B。
2C(g)+2D(g)可看出:反应时A 、B、C、D的物质的量的关系是3:1:2:2,因为生成0.8mol的D,所以消耗A1.2mol,消耗B0.4mol,生成C0.8mol。故A的平衡浓度为:(2-1.2)mol÷2L="0.4mol∕L" . B的转化率为:0.4mol÷2mol× 100%="20%," 0-2min内D的平均反应速率为V="ΔC∕" Δt="(0.8mol÷2L)" ∕2min=" 0.2" mol∕(L·min).(2)化学平衡常数是可逆反应达到化学平衡时各生成物浓度幂指数的积与各反应物浓度幂指数的积之K={C2(C)C2(D) }∕{C3(A)C (B)}。达到化学平衡时各物质的浓度分别是C(A)=" 0.4mol∕L" ;C(B)="(2-0.4)mol÷2L=0.8mol∕L" ;C(C)=" 0.8mol" ÷2L="0.4" mol∕L ;C(D)=" 0.8mol" ÷2L="0.4" mol∕L。所以化学平衡常数为:K1={(0.4)2×(0.4)2}∕{(0.4)3×0.8}=0.5.又因为在350℃时K2=l,可见升高温度,K增大,说明升高温度化学平衡向正反应方向移动。根据化学平衡移动原理:升高温度,化学平衡向吸热反应方向移动。即正反应是吸热反应。故△H>0.(3)将反应容器体积压缩,也就是增大压强。根据化学平衡移动原理:增大压强,化学平衡向气体体积减小的方向移动。而该反应是个反应前后气体体积相等的反应,所以增大压强。化学平衡不移动。这时A、B的转化刻率都不会发生变化。化学平衡常数只与温度有关。而与物质投料的多少及次数无关。所以K1=K3. (4)当反应达到化学平衡时各物质的浓度不变,用同一物质表示的正反应速率和逆反应速率相等,个物质的含量不变。由于容器的体积不变,该反应是个反应前后气体体积相等的反应,所以任何时刻压强不变,气体的密度也不变,故它们不能作为判断平衡的标志。正确选项为:B。
