(9分)已知:2SO2(g)+O2(g) 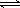 2SO3(g);△H=-196 kJ/mo1,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图。
2SO3(g);△H=-196 kJ/mo1,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图。
回答下列问题
(1)前10分钟内O2的平均反应速率为 mol/(L·min)
(2)平衡时,02的转化率为 ,此时反应共放热 kJ。
(3)若15分钟时维持温度不变,压缩容器体积,使其体积变为1L,假设在20分钟时达到新平衡,此时c(O2)=1.15 mol/L,请在图上画出15-25分钟SO2的浓度变化曲线。
(1)0.04(2分)
(2)40% (2分) 156.8 (2分)
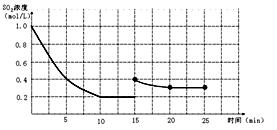
(3)(3分)
题目分析:(1)前10分钟内O2的平均反应速率=1/2V(SO2)=1/2(1-0.2)/10=0.04mol/(L·min)。(2) 一定温度下,将0.4molSO2和0.2molO2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图分析得到平衡时C(SO3)=0.1mol/L,平衡生成三氧化硫物质的量=0.1mol/L×2L=0.2mol;依据化学平衡三段式列式计算
2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ/mol,
起始量(mol/L) 1 1 0
变化量(mol/L) 08 0.4 0.8
平衡量(mol/L) 0.2 0.6 0.8
故氧气的转化率=0.4/1=40%。Q=0.8*196.6=156.8kJ。
(2)在第15分钟末将容器的体积缩小一半后,此时各物质的量浓度增加一倍,压强增大平衡正向进行,在20分钟时达到新平衡,此时c(O2)=1.15 mol/L,
2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ/mol,
起始量(mol/L) 0.4 1.2 1.6
变化量(mol/L) 0.1 0.05 0.1
平衡量(mol/L) 0.3 1.15 1.7
终点二氧化硫的浓度为0.3 mol/L,曲线变化慢慢向下,20分钟之后浓度不变。故图形如下:

