问题
选择题
已知:SO2(g)+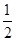 O2(g)
O2(g) SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是( )
SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是( )
A.5 min内用O2表示的反应速率为0.12 mol/(L·min)
B.该反应的平衡常数数值为7.5
C.SO2的平衡转化率为60%
D.加入催化剂,可使ΔH变小
答案
答案:C
A项,根据反应热可知Δn(SO2)=11.76/98mol=0.12 mol=Δn(SO3),则Δn(O2)=0.06 mol,v(O2)=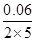 mol/(L·min)=0.006 mol/(L·min);B项,
mol/(L·min)=0.006 mol/(L·min);B项,
K=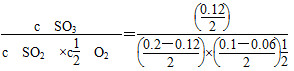 =10.61;C项,SO2转化率=
=10.61;C项,SO2转化率=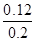 ×100%=60%;D项,加入催化剂只能加快反应速率,平衡不移动,转化率不变,故反应热也不变。
×100%=60%;D项,加入催化剂只能加快反应速率,平衡不移动,转化率不变,故反应热也不变。
点拨:本题考查化学平衡,考查考生综合分析能力。难度中等。
