问题
选择题
一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:
2SO2(g)+O2(g)  2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前t1s的平均速率v(O2)=0.4/t1 mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大
答案
答案:D
2SO2+O2 2SO3
2SO3
起始/mol 2 1 0
平衡/mol 2-2a 1-a 2a
2a=1.8 mol a=0.9 mol
A项,v(O2)= v(SO3)=
v(SO3)= ×
×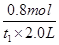 =
=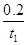 mol·L-1·s-1错误;B项,平衡常数只与温度有关,错误;C项,原平衡,SO2的转化率为
mol·L-1·s-1错误;B项,平衡常数只与温度有关,错误;C项,原平衡,SO2的转化率为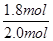 ×100%=90%,当向容器中充2 mol SO3时,SO3的转化率等于10%,当充入4 mol SO3,相当于加压,SO3的转化率减小,应小于10%,错误;D项,相当于缩小容器的体积,平衡右移,n(SO3)/n(O2)增大,正确。
×100%=90%,当向容器中充2 mol SO3时,SO3的转化率等于10%,当充入4 mol SO3,相当于加压,SO3的转化率减小,应小于10%,错误;D项,相当于缩小容器的体积,平衡右移,n(SO3)/n(O2)增大,正确。
