298 K时,某容积固定为1 L的密闭容器中发生如下可逆反应:A(g) 2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。

试回答下列问题。
(1)已知298 K时60 s达到平衡,比较40~60 s内和60~80s内B的平均反应速率:v(40~60) v(60~80)(填“﹥”或“﹦”或“﹤”)。
(2)若298 K达到平衡时,B的平衡浓度为A的3倍,共放出热量x kJ,开始加入A的物质的量是 mol。
(3)298k时,该反应的平衡常数为 mol/L。
(4)若反应在298 K进行,在1 L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡时共吸收热量y kJ,此时B的转化率为 (填序号)。
A.等于60% B.等于40%
C.小于40% D.介于40%~60%之间
(5)结合(2)、(4)相关数据,写出a、x、y三者的等式关系式: 。
(6)若反应在298K进行,反应起始浓度为c(A)=c(B)=1.0mol/L,则化学平衡将 (填“正向”“逆向”或“不”)移动。
(7)已知曲线上任意两点之间连线的斜率表示该时间段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),则曲线上任意一点的切线斜率的意义是 。
(1)﹥ (2)0.5 (3)1.8 (4)B (5)a=2x+2y (6)正向
(7)某一时刻的反应速率(或即时速率、瞬时速率)。
题目分析:(1)40~60 s内B的浓度有0.53mol·L-1变为0.6mol·L-1而60~80s内B的浓度不再变化,故v(40~60)﹥v(60~80)。
(2)平衡浓度c(B)="3c(A)=" 0.6mol·L-1,1L中,由反应将反应产物0.6mol B转化为0.3mol A,则开始加入A的物质的量是0.50mol。
(3)298k时,该反应的平衡常数K=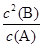 =
=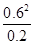 =1.8mol/L。
=1.8mol/L。
(4)原反应中起始时的c(A)=0.5,平衡时转化0.3 mol·L-1,转化率为60%,若100%的转化得到1molB;在1 L密闭容器中加入1 mol B、0.2 mol Ne,与Ne无关,因此,两个平衡等效,后一个转化率为40%。
(5)有上述(4)分析可知a=2x+2y。
(6)c(A)=c(B)=1.0mol/L,Qc=1.8mol/L<K,则化学平衡正向移动。
(7)按极限规律,曲线上任意一点的切线斜率的意义是该时刻的反应速率。
