某温度下,将0.2 mol C(s)和0.3 mol H2O(g),投入2 L的密闭容器中,发生反应C(s)+H2O(g)  CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是( )
CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是( )
A.从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol·L-1·min-1
B.达平衡时压强变为原来的7/6
C.此温度下该反应的平衡常数为0.012 5
D.若保持温度和体积不变,向平衡体系中再加入0.2 mol C(s)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7%
答案:B
C(s) + H2O(g)  CO(g)+H2(g)
CO(g)+H2(g)
起始 0.2 mol 0.3 mol 0 0
平衡 0.2 mol-x 0.3 mol-x x x
则:12x=0.3 g·L-1×2 x=0.05 mol
A项,C是固体,其浓度为常数,不能用它表示反应速率,错误;B项,压强之比为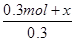 =
= =
=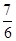 正确;C项,K=
正确;C项,K=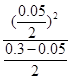 =0.005,错误;D项,原平衡时,α(H2O)=
=0.005,错误;D项,原平衡时,α(H2O)=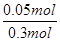 ×100%=16.7%,再加入0.2 mol C(s),0.3 mol H2O(g)平衡右移,但正反应是体积增大的反应,H2O(g)的转化率减小,错误。
×100%=16.7%,再加入0.2 mol C(s),0.3 mol H2O(g)平衡右移,但正反应是体积增大的反应,H2O(g)的转化率减小,错误。
