加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g·mL-1),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题。
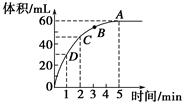
(1)A、B、C、D四点化学反应速率快慢的顺序为____________________。
(2)解释反应速率变化的原因__________________________________。
(3)计算过氧化氢的初始物质的量浓度________。
(4)求反应进行到2分钟时过氧化氢的质量分数。
(1)D>C>B>A
(2)随着反应的进行,过氧化氢溶液的浓度越来越小,反应速率越来越小
(3)0.107 mol·L-1 (4)0.083%
(1)曲线斜率越大,反应速率越大。
(2)随着反应的进行,反应物H2O2的浓度逐渐减小,因此反应速率逐渐减小。
(3)根据图像可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2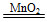 2H2O+O2↑,则
2H2O+O2↑,则
n(H2O2)=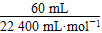 ×2≈0.005 36 mol,
×2≈0.005 36 mol,
c(H2O2)=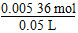 ≈0.107 mol·L-1。
≈0.107 mol·L-1。
(4)反应进行到2分钟时,放出O2 45 mL,则反应生成O2的物质的量为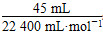 ≈0.002 01 mol,
≈0.002 01 mol,
质量为0.002 01 mol×32 g·mol-1≈0.064 3 g
反应消耗的H2O2物质的量为
0.002 01 mol×2=0.004 02 mol,
0.005 36 mol-0.004 02 mol=0.001 34 mol,
则2分钟时H2O2的质量分数为
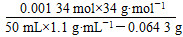 ×100%≈0.083%。
×100%≈0.083%。
