光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
已知COCl2(g)  Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
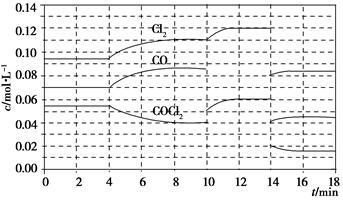
(1)化学平衡常数表达式K=________,计算反应在第8 min时的平衡常数K=________;
(2)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________;10~12 min内CO的平均反应速率为v(CO)=________;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率(平均反应速率分别以v(2~3)、v(5~6)、v(12~13))的大小________________。
(1) 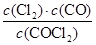 0.234 (2)<
0.234 (2)<
(3)0.031 mol·L-1 0.005 mol·L-1·min-1
(4)v(5~6)>v(2~3)=v(12~13)
(1)由题图示可知8 min时COCl2、Cl2、CO三种物质的浓度分别为
0.04 mol·L-1、0.11 mol·L-1、0.085 mol·L-1。所以此时其平衡常数为:0.11 ×0.085 ÷0.04 =0.234。(2)第8 min时反应物的浓度比第2 min时减小,生成物浓度增大,平衡向正反应方向移动。又因为正反应为吸热反应,所以T(2)<T(8)。(4)根据图像可知反应在2~3 min和12~13 min时反应处于平衡状态,平均反应速率为0,故v(5~6)>v(2~3)>v(12~13)。
