先阅读短文,然后根据要求答题。
The Dragon Boat Festival (端午节) is the day to remember a Chinese national hero, Qu Yuan, who threw
himself into the river and died over 2,000 years ago. Old story has it that people, in order to save Qu Yuan,
beat drums to drive fish away, and threw rice dumplings (zong zi) into the river to keep the fish from eating
his body.
For thousands of years, people have spent the festival by eating zong zi and holding dragon boat races on
the fifth day of the fifth lunar(阴历的) month, especially in the 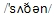 provinces where there are many
provinces where there are many
rivers and lakes.
The dragon boat races 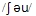 that many people want to save Qu's body. Those races are the most exciting
that many people want to save Qu's body. Those races are the most exciting
part of the festival, with very large crowds of people watching them. The special boats, more than 10 meters
long, have colorful "dragon"heads and tails (尾巴), and 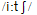 boat carries a team of 20 or 22 players. Every
boat carries a team of 20 or 22 players. Every
year dragon boat races take place in southeast Asian countries and some western countries, including America,
Canada, Australia and New Zealand.
一. 根据短文内容完成下列语音题:
1. Write out the word 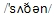 .
.
2. Write out the word 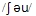 .
.
3. Write out the word 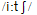 .
.
4. In the underlined sentence find two words that can be read together (连读).
5. In the underlined sentence find a word whose last sound can have incomplete plosion(失去爆破).
二. 根据短文内容填入一个适当的词:
1. The Dragon Boat Festival is the day for people to keep Qu Yuan in their _____.
2. The Dragon Boat Festival has a history of more than two _____ years.
3. Since the Dragon Boat Festival falls on the fifth day of the fifth lunar month, can we call it "The Double _____
Festival"?
4. Dragon boat races are mostly held in South China because there are more _____ areas there.
5. Dragon boat races are becoming more and more _____ in the world.
 N2O4(g),前20 s内v(N2O4)=
N2O4(g),前20 s内v(N2O4)=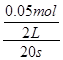 =0.001 25 mol·L-1·
=0.001 25 mol·L-1·
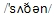 provinces where there are many
provinces where there are many 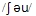 that many people want to save Qu's body. Those races are the most exciting
that many people want to save Qu's body. Those races are the most exciting 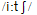 boat carries a team of 20 or 22 players. Every
boat carries a team of 20 or 22 players. Every