问题
选择题
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T3 |
| 反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
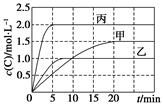
下列说法正确的是( )
A.10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
答案
答案:C
A项,v(A)=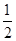 v(C)=
v(C)=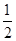 ×
×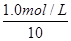 =0.05 mol·L-1·min-1,错误;
=0.05 mol·L-1·min-1,错误;
B项,甲和乙比较,乙达平衡所用时间短,说明T2>T1,T2高,C的浓度小,升温,平衡左移,正反应应为放热反应,错误;
C项,乙和丙相比较,起始量丙是乙的4倍,体积丙是乙的2倍,平衡量丙是乙的2倍,说明该反应是等体积反应,所以x=1,改变压强平衡不移动,正确;
D项, A(g) + B(g)  2C(g)
2C(g)
起始 mol/L 3 1 0
平衡 mol/L 2.25 0.25 1.5
K=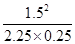
设转化的A为a mol·L-1
则K=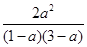 =
=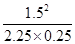 a=0.75 mol·L-1
a=0.75 mol·L-1
所以α(A)=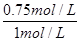 ×100%=75%,错误。
×100%=75%,错误。
