(14分)2SO2(g)+O2(g) 2SO3(g)是生产硫酸的主要反应之一。下表是原料气按
2SO3(g)是生产硫酸的主要反应之一。下表是原料气按
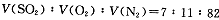 投料,在
投料,在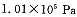 时,不同温度下SO2的平衡转化率。
时,不同温度下SO2的平衡转化率。

(1)该反应是_ 反应(填“放热”或“吸热”)。
(2)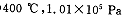 时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。
时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。
(3)硫酸厂尾气(主要成分为SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若尾气中SO2与氨水恰好反应得到弱碱性的(NH4)2SO3溶液,则有关该溶液的下列关系正确的是 (填序号)。
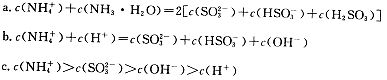
②用MnO2与水的悬浊液吸收上述尾气并生产MnSO4
i.得到MnSO4的化学方程式是
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2的吸收率与溶液pH的关系如图乙。

图甲中pH变化是因为吸收中有部分SO2转化为H2SO4生成H2SO4反应的化学方程式是____;由图乙可知pH的降低 SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是 。
(14分)
(1)放热
(2)0.08
(3)①ac
②i.H2O+SO2 H2SO3 MnO2+ H2SO3= MnSO4+H2O(或MnO2+ SO2= MnSO4)
H2SO3 MnO2+ H2SO3= MnSO4+H2O(或MnO2+ SO2= MnSO4)
ii.2SO2+2H2O+ O2=2 H2SO4
不利于 溶液中存在H2O+SO2 H2SO3
H2SO3 H++ HSO3-,当溶液中酸性增强,平衡向左移动,使二氧化硫从体系中逸出。
H++ HSO3-,当溶液中酸性增强,平衡向左移动,使二氧化硫从体系中逸出。
题目分析:(1)温度升高二氧化硫的转化率降低,说明升高温度平衡逆向移动,所以正向为放热反应;
(2)该条件下二氧化硫的转化率为99.2%,所以10 mol SO2的原料气平衡时剩余10×(1-99.2%)="0.08mol" SO2
(3)①根据物料守恒规律,c(NH4+)+c(NH3·H2O)=2c(H2SO3)+2c(SO32-)+ 2c(HSO3-),a正确;b不符合电荷守恒规律,错误;(NH4)2SO3溶液为碱性溶液,说明SO32-的水解程度大于NH4+的水解程度,所以溶液中离子浓度的大小关系是c(NH4+)>c(SO32-)>c(OH-)>c(H+),c正确;答案选ac;
②i.二氧化硫与水反应生成亚硫酸,亚硫酸与二氧化锰发生氧化还原反应生成硫酸锰,化学方程式为H2O+SO2 H2SO3 MnO2+ H2SO3= MnSO4+H2O;
H2SO3 MnO2+ H2SO3= MnSO4+H2O;
ii.SO2与水、氧气反应生成硫酸,化学方程式为2SO2+2H2O+ O2="2" H2SO4;由乙图可知,pH减小,二氧化硫的吸收率下降,所以pH的降低不利于SO2的吸收;因为二氧化硫溶于水后存在平衡H2O+SO2 H2SO3
H2SO3 H++ HSO3-,当溶液中酸性增强,平衡向左移动,使二氧化硫从体系中逸出。
H++ HSO3-,当溶液中酸性增强,平衡向左移动,使二氧化硫从体系中逸出。
