甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如下图。
CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如下图。
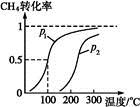
①已知100 ℃压强为p1时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为 。
②图中的p1 p2(填“<”“>”或“="”),100" ℃压强为p2时平衡常数为 。
③该反应的ΔH 0(填“<”“>”或“=”)。
(2)在一定条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) CH3OH(g) ΔH<0 ……Ⅱ
CH3OH(g) ΔH<0 ……Ⅱ
①若容器容积不变,下列措施可增加甲醇产率的是( )
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验表格中。
A.下表中剩余的实验条件数据:a= ;b= 。
。
B.根据反应Ⅱ的特点,下图是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px= MPa。
| 实验编号 | T/℃ | n(CO)/n(H2) | p/MPa |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
(1)①0.003 0 mol·L-1·min-1 ②< 2.25×10-4 ③>
(2)①BD ②150 0.1
(1)①v(H2)=3v(CH4)=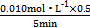 ×3="0.003" 0 mol·L-1·min-1;②依据反应式可知增大压强平衡左移,转化率减小,所以p1<p2;用“三部曲”可求出在100 ℃压强为p1时平衡时各物质的浓度分别为c(CH4)="0.005" mol·L-1、c(H2O)="0.015" mol·L-1、c(CO)="0.005" mol·L-1、c(H2)="0.015" mol·L-1,K=
×3="0.003" 0 mol·L-1·min-1;②依据反应式可知增大压强平衡左移,转化率减小,所以p1<p2;用“三部曲”可求出在100 ℃压强为p1时平衡时各物质的浓度分别为c(CH4)="0.005" mol·L-1、c(H2O)="0.015" mol·L-1、c(CO)="0.005" mol·L-1、c(H2)="0.015" mol·L-1,K=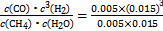 =2.25×10-4;(2)①C选项相当于减压、D选项相当于加压;②设计实验应该只有一个变量,实验1、2压强不同,温度相同;实验2、3温度不同,其他相同;压强越大转化率越高,px的压强小。
=2.25×10-4;(2)①C选项相当于减压、D选项相当于加压;②设计实验应该只有一个变量,实验1、2压强不同,温度相同;实验2、3温度不同,其他相同;压强越大转化率越高,px的压强小。
