硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:SO2Cl2(g) SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____ kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
SO2(g)+Cl2(g) △H=+97.3 kJ·mol-1。某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为_____ kJ,该温度时反应的平衡常数为_____。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为_______。
(2)工业上制备硫酸的过程中存在反应:2SO2(g)+O2(g) 2SO3(g) △H=-198kJ·mol-1,400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
2SO3(g) △H=-198kJ·mol-1,400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
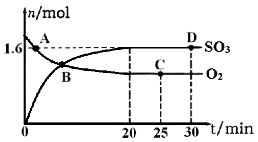
①0~20min反应的平均速率υ(O2)=___________。
②下列叙述正确的是 。
a.A点υ正(SO2)>υ逆(SO2)
b.B点处于平衡状态
c.C点和D点n(SO2)相同
d.其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是__mol·L-1。
(1)17.5 1.62 46.6g
(2)0.02mol/(L·min) ac
(3)1.6mol/L
(1)达到平衡时,容器中含0.18mol SO2,则根据热化学方程式可知,此过程反应吸收的热量为97.3 kJ·mol-1×0.18mol=17.5kJ。根据方程式可知
SO2Cl2(g) SO2(g)+Cl2(g)
SO2(g)+Cl2(g)
起始浓度(mol/L) 0.20 0 0
转化浓度(mol/L) 0.18 0.18 0.18
平衡浓度(mol/L) 0.02 0.18 0.18
所以该温度下反应的平衡常数K=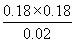 =1.62。
=1.62。
所得混合气体溶于足量BaCl2溶液中,发生反应SO2+Cl2+2H2O=H2SO4+2HCl,所以促使平衡持续向正反应方向进行,因此最终生成沉淀的物质的量是0.20mol,则硫酸钡的质量为0.20mol×232g/mol=46.6g。
(2)①根据图像可知20min时三氧化硫的物质的量是1.6mol,则消耗氧气的物质的量是0.8mol,浓度是0.4mol/L,所以0~20min反应的平均速率υ(O2)=0.4mol/L÷20min=0.02mol(L·min);
②a.根据图像可知A点反应没有达到平衡状态,平衡向正反应方向进行,则υ正(SO2)>υ逆(SO2),a正确;b.B点物质的浓度仍然是变化的,反应没有处于平衡状态,b不正确;c.C点和D点均是相同条件下的平衡状态,因此n(SO2)相同,c正确;d.正方应是放热反应,其它条件不变,升高温度平衡向逆反应方向移动,所以500℃时反应达平衡,n(SO3)比图中D点的值小,d不正确,答案选ac。
(3)溶液中c (SO32-)的浓度是0.2 mol·L-1,则消耗c (SO32-)的浓度=1.0mol/L-0.2mol/L=0.8mol/L,因此根据方程式SO32-+SO2+H2O=2HSO3-可知溶液c(HSO3-)=0.8mol/L×2=1.6mol/L
