在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
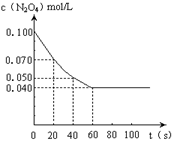
(1)计算在20至40秒时间内,NO2的平均生成速率为 mol•L-1•S -1。
(2)①该反应的化学平衡常数表达式为 。
②求该温度下平衡常数的值。(写出计算过程,下同)
(3)求达到平衡状态时N2O4的转化率。
(4)求平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)。
(1)0.002(2分)(2)①K= C2(NO2)/C(N2O4) (2分) ②0.36(2分)
(3)60%(2分) (4)8:5(2分)
题目分析:(1)由图象可知,20至40秒时间内N2O4的浓度由0.07mol/L减小为0.050mol/L,
则其反应速率为(0.07mol/L−0.05mol/L)÷20s=0.001mol/(L.s),由反应速率之比等于化学计量数之比,则NO2的反应速率为0.001mol/(L.s)×2=0.002mol/(L.s),故答案为:0.002;
(2)①平衡常数为生成物浓度幂之积与反应物浓度幂之积的比,则K=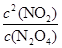 ,故答案为:K=
,故答案为:K=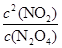 ;
;
②根据图像可知反应到60s时达到平衡状态,平衡时消耗N2O4的浓度为0.100mol/L-0.040mol/L=0.060mol/L,所以根据方程式可知生成NO2的浓度为0.060mol/L×2=0.120mol/L,因此平衡常数K=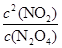 =
= =0.036;
=0.036;
(3)根据以上分析可知达到平衡状态时N2O4的转化率为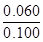 ×100%=60%;
×100%=60%;
(4)根据阿伏加德罗定律可知平衡时容器内气体压强与反应前的压强之比为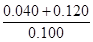 =8:5。
=8:5。
