分1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的。现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
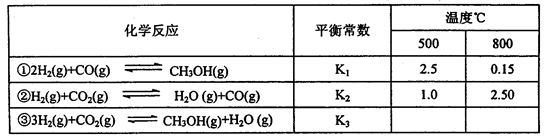
(1)反应②是____________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图所示。则平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”)。

据反应①与②可推导出K1、K2与K3之间的关系,则K3=_________(用K1、K2表示
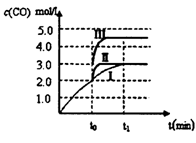
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如下图所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_____________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,
以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是_________________;
(5)一定条件下甲醇与一氧化碳反应可以合成醋酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为_____________。
(1)吸热(2分) (2) =(2分) K1·K2 (2分)
(3)加入催化剂(2分); 将容器的体积(快速)压缩至2L(2分,仅答“加压”给1分)
(4) CH3OH-6 e-+8 OH-=CO32-+6 H2O;
(5)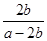 ×10-7 (3分)
×10-7 (3分)
题目分析:(1) 反应②随着温度的升高K增大,故正反应为吸热反应;
(2)平衡常数只随温度变化,与压强无关,平衡常数K(A)=K(B);据反应①+②=③可推导反应物质的浓度在K中是幂之积的关系,即K3=K1·K2。
(3)曲线Ⅰ变为曲线II时,反应速率加快,而c(CO)平衡浓度不变,改变的条件是加入催化剂;曲线Ⅰ变为曲线III时,反应速率加快,c(CO)平衡浓度增加,改变的条件是将容器的体积(快速)压缩至2L(仅答“加压”不准确)
(4) 甲醇是该碱性燃料电池的负极,失去电子,反应式是CH3OH-6 e-+8 OH-=CO32-+6 H2O ;
(5)将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-)="2b" mol/L,由电荷守恒得出c(H+)=c(OH-)= 10-7 mol/L;因CH3COOH CH3COO-+H+,醋酸的电离常数为
CH3COO-+H+,醋酸的电离常数为
