【化学——选修2:化学与技术】(15分)
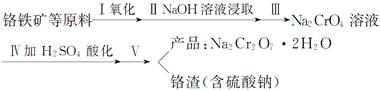
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作辅助剂,在化学工业和制药工业中也可作氧化剂,应用领域十分广泛。实验室中红矾钠可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量铝的氧化物)通过以下过程来制取。
回答下列问题:
(1)步骤Ⅰ中反应化学方程式为___FeO·Cr2O3+___Na2CO3+___O2===___Na2CrO4+___Fe2O3+___CO2。在常温下该反应速率极慢,下列措施中能使反应速率增大的是________(填字母序号)。
A.将原料粉碎 B.增加纯碱的用量 C.升高温度
(2)步骤Ⅲ需将溶液的pH调至7~8,并煮沸,其目的是________________________。
(3)步骤Ⅳ中发生反应的离子方程式为________________________________________。
(4)利用下面的复分解反应,将红矾钠与KCl固体按1∶2物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体:Na2Cr2O7+2KCl===K2Cr2O7+2NaCl(已知:温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大)。基本实验步骤为①溶解;②________;③________;④冷却、结晶,再过滤得K2Cr2O7晶体。其中③应在_________________(填“高温”或“低温”)条件下进行。
(1)4、8、7、8、2、8;AC
(2)除去AlO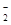 杂质
杂质
(3)2CrO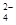 +2H+===Cr2O
+2H+===Cr2O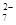 +H2O
+H2O
(4)②蒸发 ③过滤 高温
题目分析:(1)根据氧化还原反应电子都是配平:4FeO·Cr2O3+8Na2CO3+7O2===8Na2CrO4+2Fe2O3+8CO2。将原料粉碎可增大反应物的接触面积,加快反应速率,A项正确;对于有气体参加或生成的反应来说,增加或减少固体物质用量,不会影响化学反应速率,B项错误;升高温度可加快反应速率,C项正确。
(2)由于题中明确铬铁矿中含有少量铝的氧化物,故后续操作必须除去铝,要注意的是本题不能回答除铁,原因是步骤Ⅰ中反应已生成Fe2O3。
(3)利用步骤Ⅴ的反应可反推步骤Ⅳ中生成物是Na2Cr2O7,由此可知酸化时发生了CrO离子的缩合反应。
(4)由于④进行冷却结晶,故③必为趁热过滤。