某温度下,将0.2 mol C(s)和0.3 mol H2O(g),投入2 L的密闭容器中,发生反应C(s)+H2O(g) CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
A.从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol·L-1·min-1
B.达平衡时压强变为原来的7/6
C.此温度下该反应的平衡常数为0.005
D.若保持温度和体积不变,向平衡体系中再加入0.2 mol C(s)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7%
BC
题目分析:A、碳是固体,不能用来表示反应速率,A不正确;B、5 min达到平衡后,密度增加了0.3 g/L,则容器中气体的质量增加了0.6g,则根据方程式C(s)+H2O(g) CO(g)+H2(g)可知增加的质量就是参加反应的碳的质量,物质的量是0.6g÷12g/mol=0.05mol,则
CO(g)+H2(g)可知增加的质量就是参加反应的碳的质量,物质的量是0.6g÷12g/mol=0.05mol,则
C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
起始量(mol) 0.3 0 0
转化量(mol) 0.05 0.05 0.05
平衡量(mol) 0.25 0.05 0.05
因此达平衡时压强变为原来的(0.25+0.05+0.05)÷0.3=7/6,B正确;
此温度下该反应的平衡常数为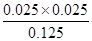 =0.005,C正确;
=0.005,C正确;
若保持温度和体积不变,向平衡体系中再加入0.2 mol C(s)和0.3 mol H2O(g),相当于是增大压强,平衡向正反应方向移动,因此水蒸气的转化率将大于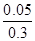 ×100%=16.67%,D不正确,答案选BC。
×100%=16.67%,D不正确,答案选BC。
