某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
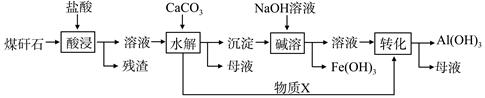
(1)“酸浸”过程中主要反应的离子方程式为_____________、_________________。
(2)“酸浸”时铝浸出率的影响因素可能有_____________、___________。(写出两个)
(3)物质X的化学式为___________。“碱溶”时反应的离子方程式为____________。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得产品Al(OH) 3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是____________________。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:_______________________。
(1)Al2O3+6H+==2Al3++3H2O ; Fe2O3+6H+==2Fe3++3H2O (4分,每个2分)
(2)盐酸的浓度、反应温度、煤矸石颗粒大小、是否充分搅拌、反应时间(任写两个)(4分,每个2分)
(3)CO2; Al(OH)3 +OH—=AlO2—+2H2O (4分,每个2分)
(4)加入CaCO3调节pH到3.2,过滤除去Fe(OH) 3后,再加入CaCO3调节pH到5.4,过滤得到Al(OH) 3 (2分)
(5)AlCl3饱和溶液中存在溶解平衡:AlCl3·6H2O(s) Al3+(aq) +3Cl—(aq) +6H2O(l),通入HCl气体使溶液中c(Cl—)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。 (2分)
Al3+(aq) +3Cl—(aq) +6H2O(l),通入HCl气体使溶液中c(Cl—)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。 (2分)
题目分析:(1)根据煤矸石经预处理后含成分可知,能与HCl主要反应的为Al2O3、Fe2O3,其反应的离子
方程式为Al2O3+6H+==2Al3++3H2O、 Fe2O3+6H+==2Fe3++3H2O ;
(2)影响酸浸因素有盐酸的浓度、反应温度、表面积(煤矸石颗粒大小)、是否充分搅拌、反应时间等;
(3)酸浸后的溶液呈酸性,一方面是剩
余的HCl,另一方面是Al3++3H2O Al(OH)3+3H+、Fe3++3H2O
Al(OH)3+3H+、Fe3++3H2O Fe(OH)3+3H+的水解呈酸性,加入CaCO3后与其H+反应生成CO2;因Al(OH)3是两性氢氧化物,既能溶液酸,又能溶于强碱,向沉淀中
Fe(OH)3+3H+的水解呈酸性,加入CaCO3后与其H+反应生成CO2;因Al(OH)3是两性氢氧化物,既能溶液酸,又能溶于强碱,向沉淀中
加如碱时,反应的离子方程式为Al(OH)3 +OH—=AlO2—+2H2O;
(4)根据Fe3+、Al3+沉淀的pH可知,使Fe3+沉淀时,Al3+离子不能沉淀,故应将pH调至到3.2,为了获得产品Al(OH) 3,则需要Al3+离子完全沉淀,故将pH调至到5.4,在第二步调节pH之前,应用过滤的方法将Fe(OH) 3除去;(5)AlCl3饱和溶液中存在溶解平衡,通入HCl气体溶于水电离出Cl—,使溶液中c(Cl—)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。
