问题
选择题
下列说法正确的是( )
A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++N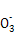 =4Mg2++N
=4Mg2++N +3H2O
+3H2O
B.常温下,0.1 mol/L一元酸HA溶液中c(OH-)/c(H+)=1×10-8,则此溶液的pH=3
C.相同条件下,浓度均为0.01 mol/L的NH4Cl溶液和NaCl溶液中,前者的阳离子总浓度大于后者的阳离子总浓度
D.物质的量浓度相等的醋酸和氢氧化钠溶液等体积混合后的溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH)
答案
答案:B
A项电荷、原子不守恒,应为4Mg+10H++N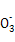 =4Mg2++N
=4Mg2++N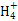 +3H2O,错误;c(OH-)/c(H+)=1×10-8与c(OH-)×c(H+)=1×10-14联立,可得c(H+)=1×10-3 mol·L-1,故pH=3,B对;根据溶液电中性,NH4Cl溶液中存在c(N
+3H2O,错误;c(OH-)/c(H+)=1×10-8与c(OH-)×c(H+)=1×10-14联立,可得c(H+)=1×10-3 mol·L-1,故pH=3,B对;根据溶液电中性,NH4Cl溶液中存在c(N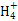 )+c(H+)=c(Cl-)+c(OH-),NaCl溶液中存在c(Na+)+c(H+)=c(Cl-)+c(OH-),由于NH4Cl溶液显酸性而NaCl溶液显中性,即前者的c(OH-)小于后者,而c(Cl-)均为0.01 mol/L,故c(N
)+c(H+)=c(Cl-)+c(OH-),NaCl溶液中存在c(Na+)+c(H+)=c(Cl-)+c(OH-),由于NH4Cl溶液显酸性而NaCl溶液显中性,即前者的c(OH-)小于后者,而c(Cl-)均为0.01 mol/L,故c(N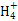 )+c(H+)<c(Na+)+c(H+),C错;根据溶液电中性,CH3COONa溶液中存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),D错。
)+c(H+)<c(Na+)+c(H+),C错;根据溶液电中性,CH3COONa溶液中存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),D错。
